Innehåll
Andra avsnittAtomer är byggstenarna för all materia. Olika typer av atomer kallas 'element' och de sammanställs i ett diagram som kallas det periodiska systemet. I tabellen kan liknande element grupperas tillsammans baserat på deras kemiska egenskaper. Intressant är att atomer i samma grupp ofta också har liknande fysiska egenskaper. Om du vill få en förståelse för de kemiska och fysiska egenskaperna hos atomer, lär dig att dela upp det periodiska systemet i grupper och studera var och en av egenskaperna för varje grupp.
Steg
Metod 1 av 3: Dela upp det periodiska systemet
Leta upp elementen som är icke-metalliska. I det periodiska systemet klassificeras majoriteten av atomerna som metaller. Andra atomer klassificeras som icke-metaller. Du kommer att hitta dessa grupperingar fördelaktiga när du utforskar egenskaperna hos olika atomer.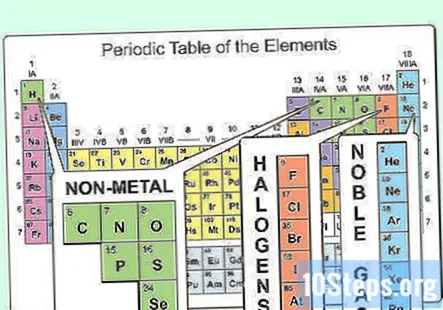
- Icke-metaller finns främst i det övre högra hörnet av det periodiska systemet, medan resten av tabellen huvudsakligen består av metaller. Väte är ett undantag från denna regel, eftersom det fungerar som ett icke-metalliskt under standardförhållanden, men det finns i det övre vänstra hörnet av bordet.
- Kol, kväve, syre, väte, svavel och ädelgaser (grundämnena i den högra kolumnen) är allmänt kända icke-metaller.
- Halogener (såsom fluor, klor, brom, etc.) faller inom kategorin icke-metall.

Differentiera de stora metallgrupperna. Metaller grupperas i underkategorier. Element inom dessa underkategorier är lika på mer specifika sätt än att bara identifiera båda som metaller. De vanliga kategorierna är alkalimetaller, jordalkalimetaller, övergångsmetaller, efterövergångsmetaller, lantanider och aktinider.- Alkalimetaller är mycket reaktiva och joniseras lätt till ett tillstånd.
- Jordalkalimetaller är något mindre reaktiva, men joniseras lätt till ett 2-tillstånd.
- Övergångs- och efterövergångsmetaller är mer stabila och har många olika joniseringstillstånd.
- Lantanider och aktinider är större, mindre stabila molekyler som lätt reagerar. Vissa av dem bryts ned och gör dem radioaktiva.

Föreställ dig något mellan metall och icke-metall. Sådana element finns, och de är kända som metalloider. På det periodiska systemet visas metalloider mellan metaller efter övergång och icke-metaller. Det finns åtta metalloider:- Bor
- Kisel
- Germanium
- Arsenik
- Antimon
- Tellur
- Polonium
- Astat
Metod 2 av 3: Analys av kemiska egenskaper

Titta på tabellens ordning. När du tittar på det periodiska systemet kommer du att märka att alla element är numrerade. Denna numrering är långt ifrån slumpmässig. Egentligen är det känt som atomnummer för det specifika elementet och är lika med antalet protoner som elementet har i sin kärna.- För atomer (inte joner) representerar atomnumret också antalet elektroner i atomen. Antalet protoner och elektroner i en atom är lika.
- I vissa periodiska tabeller kommer du att märka ett andra nummer som är i ett mindre typsnitt. Detta är den genomsnittliga atommassan för det elementet.
Visualisera valenselektroner. Valenselektroner är elektronerna i det yttersta skalet av en atoms elektronmoln. Valenselektronerna är den enskilt största faktorn i hur atomen kommer att reagera kemiskt. Den mest stabila konfigurationen för en atom är att ha elektronerna i dess yttre skal fyllda, därför kommer den inte att bindas till andra atomer. I de flesta fall måste det yttre skalet innehålla åtta elektroner för att vara fulla (beroende på atomens storlek kan detta variera).
- Till exempel har fluor nio elektroner. De två första fyller den innersta banan, de återstående sju är valenselektroner. Det betyder att fluor bara behöver ytterligare en elektron för att fylla sitt valensskal. Således reagerar fluor lätt med atomer som kan ge upp en elektron (särskilt metaller).
- Ett exempel på det motsatta är litium. Litium har tre elektroner. De två första fyller det innersta skalet och det sista är en valenselektron. Eftersom litium skulle behöva få sju elektroner för att fylla sitt valensskal är det lättare (mer energiskt gynnsamt) för det att kasta den valenselektron som det har istället. Så litium reagerar lätt med element som accepterar en elektron (som halogener).
Tänk på storleken på atomen. Även om valenselektronerna är den bästa förutsägaren för kemiska egenskaper i en given atom, spelar också storleken på atomen roll. Större atomer har fler elektroner mellan kärnan och valenselektronerna, vilket innebär att de hålls fast vid atomen löstare än på mindre atomer. Detta redogör för varför två atomer med samma antal valenselektroner (till exempel fluor och klor) har liknande, men inte identiska, kemiska egenskaper.
Lär dig trenderna i det periodiska systemet. Att känna till periodiska trender kan hjälpa dig att känna igen de troliga kemiska egenskaperna hos ett element baserat på dess placering i det periodiska systemet. Det är dock viktigt att komma ihåg att tre grupper (ädelgaser, lantanider och aktinider) inte följer dessa trender på grund av sin unika kemi. Några periodiska trender är:
- Atommassan ökar från vänster till höger och från topp till botten.
- Atomradien minskar från vänster till höger och ökar från topp till botten.
- Elektronegativitet ökar från vänster till höger och minskar från topp till botten.
- Joniseringsenergin ökar från vänster till höger och minskar från topp till botten.
- Elektronaffinitet ökar från vänster till höger och minskar från topp till botten.
- Metallkaraktär minskar från vänster till höger och ökar från topp till botten.
Metod 3 av 3: Granska fysiska attribut
Identifiera icke-metalliska egenskaper. Icke-metaller finns i tre fysiska tillstånd vid rumstemperatur (fast, flytande och gas), men är främst gaser vid rumstemperatur. Icke-metaller är vanligtvis tråkiga och spröda när de är fasta, och de smälter vanligtvis och kokar vid lägre temperaturer än metaller. Icke-metaller är också dåliga ledare för värme och elektricitet.
- Det enda icke-metalliska som är en vätska vid rumstemperatur är brom.
- Kol har den högsta smältpunkten av alla element.
Känn de fysiska egenskaperna hos metaller. Metaller är glänsande och smidiga. De leder också värme och el bra. Metaller är mestadels fasta vid rumstemperatur, men kvicksilver är en vätska. Metaller har i allmänhet höga smält- och kokpunkter jämfört med icke-metaller.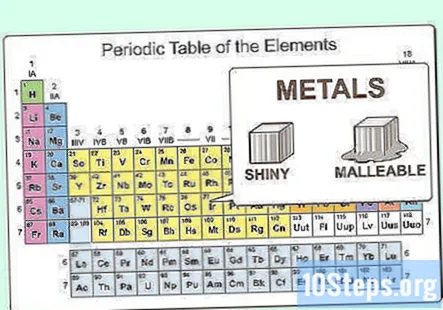
Observera ädelgaser. Elementen som utgör längst till höger kolumn är kända som ädelgaser. De är kemiskt inerta och finns alla i gasfasen vid rumstemperatur. Dessa gaser används för saker som att fylla ballonger och ljusskyltar.
Tänk på metalloider. Precis som metalloider har kemiska egenskaper hos både metaller och icke-metaller, har de fysiska egenskaper hos båda. De är halvledare. De kan vara smidiga eller spröda. De kan också vara blanka eller tråkiga.
Frågor och svar från gemenskapen
Ska inte elektronegativitet öka en grupp?

Vetenskaplig forskare Meredith Juncker är doktorand i biokemi och molekylärbiologi vid Louisiana State University Health Sciences Center. Hennes studier fokuserar på proteiner och neurodegenerativa sjukdomar.

Tips
- Du kan göra notekort för att studera olika grupper av element.
- Om du får använda en periodisk tabell för tentor och prov kan du använda den för att hjälpa dig hitta många av svaren.
Varningar
- Det finns mycket information i det periodiska systemet. Ta dig tid och studera varje dag istället för att försöka behålla den i en cram-session.